 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) emitiu um alerta nesta terça-feira (1º) sobre uma tentativa de golpe em nome da agência. “A agência recebeu a informação de que estão enviando e-mail com falsa cobrança de débito sanitário. O e-mail possui em seu assunto: Alerta de Débito Sanitário - Apólice e está assinado por Irene Ramos Da Silva”. Em nota, a Anvisa esclareceu que o remetente não pertence ao domínio da agência. A orientação é que, em caso de recebimento desse tipo de e-mail, as pessoas não cliquem em nenhum link e que também não realizem nenhum tipo de pagamento. Ainda de acordo com a Anvisa, denúncias podem ser enviadas por meio de um dos canais oficiais de atendimento da agência. As informações são da Agência Brasil.
 Foto: Divulgação/PM
Foto: Divulgação/PM A Agência Nacional de Vigilância Sanitária (Anvisa) fará uma consulta pública com o objetivo de revisar a regulamentação que trata de produtos derivados da cannabis, planta popularmente conhecida como maconha. A consulta foi aprovada na quinta-feira (26) pela diretoria colegiada da agência. A expectativa é que ela seja publicada nos próximos dias, com um link online por meio do qual será possível, aos interessados, apresentarem suas contribuições. “A minuta de resolução ficará aberta por 60 dias e, durante este período, qualquer interessado poderá fazer contribuições à proposta de atualização da regulamentação feita pela Anvisa”, informou em nota a agência. Entre as atualizações em planejamento estão algumas relacionadas a questões como atendimento às boas práticas de fabricação, vias de administração, publicidade de produtos, validade da autorização sanitária, prescrição, dispensação, importação de insumos para produção nacional, rotulagem, entre outros. Segundo o relator, Rômison Rodrigues Mota, a regularização é o único caminho possível para a “comprovação da qualidade mínima” necessária aos produtos de cannabis. “No Brasil, os produtos contendo derivados de cannabis podem ser regularizados em duas categorias distintas: como medicamento, seguindo as normas de comprovação de eficácia e segurança de medicamentos, ou como produto de cannabis, que têm um processo simplificado. Existe hoje, no país, apenas um medicamento de cannabis aprovado e 36 produtos de cannabis regularizados”, diz a nota da Anvisa. Os produtos derivados da cannabis são regulamentados pela Resolução da Diretoria Colegiada 327/2019 – regramento que define as regras para que esses produtos possam ser autorizados no país e vendidos no varejo farmacêutico. As informações são da Agência Brasil.
 Foto: Divulgação
Foto: Divulgação A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a primeira insulina semanal do mundo para o tratamento de pacientes adultos com diabetes tipo 1 e 2 no Brasil. Trata-se da medicação Awiqli, produzida pela farmacêutica Novo Nordisk. Apesar da aprovação, não há data prevista para lançamento no país. Em nota, o fabricante informou que a aprovação foi baseada em resultados do programa de ensaios clínicos Onwards, que demonstrou a eficácia do remédio no controle dos níveis de glicose em pacientes com diabetes tipo 1, alcançando controle glicêmico comparável ao da insulina basal de aplicação diária. “Pacientes que utilizaram icodeca mantiveram níveis adequados de glicemia ao longo da semana com uma única injeção”. Ainda de acordo com os estudos, a insulina icodeca também demonstrou segurança e controle glicêmico eficaz, comparável ao das insulinas basais diárias em pacientes com diabetes tipo 2. “A insulina icodeca permitiu um controle estável da glicemia ao longo da semana com uma única injeção semanal, sendo eficaz em pacientes com diferentes perfis, incluindo aqueles com disfunção renal. Em ambos os casos, a segurança foi um fator determinante e Awiqli não demonstrou aumento significativo de eventos adversos graves, incluindo hipoglicemia”.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil No último dia 12 de fevereiro, o Superior Tribunal de Justiça (STJ) decidiu manter o prazo para que a Agencia Nacional de Vigilância Sanitária (Anvisa) ou a União regulamentem, até maio, normas para o cultivo e a importação de cannabis sativa com baixo teor de THC (Tetrahidrocanabinol). A medida visa garantir a acessibilidade a medicamentos e fomentar a expansão do setor no Brasil, diante da ausência de regras claras que dificultam a produção nacional e encarecem os tratamentos. A decisão inicial havia sido em novembro de 2024 e o pedido da Anvisa e União era estender para mais 12 meses. O advogado especialista em direito cana?bico, Wesley Cesar, esclarece que ha? anos se ve? um impasse quanto a? regulamentação, pois “por um lado, temos pacientes que precisam desses medicamentos e que sofrem com os custos absurdos da importação; por outro, o governo e a Anvisa protelam a criação de regras claras para a produção nacional”. Dessa forma, a decisão do STJ seria essencial para pautar essa questão de forma responsável. Quanto às expectativas para essas novas regras, espera-se que tragam clareza sobre como as empresas poderão atuar no cultivo e na comercialização da cannabis medicinal e industrial. “Hoje, as regras são muito limitadas e obrigam a importação dos insumos, o que encarece tudo”, comenta o especialista em direito cana?bico. O especialista reforça que, embora a União e a Anvisa argumentem que o prazo seria curto demais para uma regulamentação tão complexa, a problemática ja? deveria ter sido resolvida ha? muito tempo. Desse modo, alerta que “se a Anvisa não cumprir esse prazo, pode ocorrer mais judicializac?a?o, com empresas e associações recorrendo a? Justiça para garantir o direito de produzir aqui”. Para Wesley Cesar, “o grande desafio da Anvisa e da União e? conseguir estruturar uma regulamentação que garanta segurança jurídica para quem quer atuar no setor, sem criar barreiras desnecessárias que inviabilizem a atividade”. Outro ponto crítico abordado pelo advogado e? a fiscalização, ja? que “o Brasil ainda não tem um sistema eficiente para monitorar esse tipo de produção, e isso pode se tornar um gargalo na implementação dessas novas normas”.
 Foto: Divulgação/Hemorio
Foto: Divulgação/Hemorio A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do crovalimabe, um anticorpo monoclonal indicado para o tratamento da hemoglobinúria paroxística noturna (HPN), condição sanguínea rara. De acordo com a Agência Brasil, a medicação é indicada para pacientes adultos e pediátricos, com 13 anos ou mais, e com peso corporal de pelo menos 40 quilos (kg). De acordo com a Roche Farma Brasil, fabricante do crovalimabe, trata-se do primeiro tratamento subcutâneo com aplicação rápida de baixo volume e simples administração (a cada quatro semanas) disponível no Brasil.
 Foto: Divulgação/Butantan
Foto: Divulgação/Butantan O Instituto Butantan entregou nesta segunda-feira (16) à Agência Nacional de Vigilância Sanitária (Anvisa) os documentos para a aprovação de sua vacina contra dengue, a primeira do mundo em uma única dose. Caso seja dada a autorização, a instituto terá condições de produzir 100 milhões de doses para o Ministério da Saúde pelos próximos três anos. Foram encaminhados à Anvisa três pacotes de informações sobre o imunizante. Foi a última leva de documentos necessários ao processo de autorização para a fabricação da chamada Butantan-DV. “É um dos maiores avanços da saúde e da ciência na história do país e uma enorme conquista em nível internacional. Vamos aguardar e respeitar todos os procedimentos da Anvisa, um órgão de altíssima competência. Mas estamos confiantes nos resultados que virão”, afirma Esper Kallás, diretor do Instituto Butantan. As informações são da Agência Brasil.
 Foto: Lay Amorim/Achei Sudoeste
Foto: Lay Amorim/Achei Sudoeste A Fundação Oswaldo Cruz (Fiocruz) formalizou um pedido ao Ministério da Saúde para desenvolver uma vacina contra a dengue no país. As informações são da Agência Brasil. Caso aceita, a produção será da vacina Qdenga, da fabricante japonesa Takeda, por meio de um acordo de transferência de tecnologia na modalidade Parceria para o Desenvolvimento Produtivo (PDP). As informações foram confirmadas pela Takeda e pela Fiocruz. A instituição brasileira disse, em nota, que poderá dar mais detalhes sobre o processo “após a avaliação da proposta encaminhada”. O Ministério da Saúde já havia comunicado anteriormente que foram compradas quatro milhões de doses da vacina do laboratório japonês em 2024 e que, para 2025, havia contrato para distribuição de nove milhões de doses. Segundo dados da pasta, que constam no painel de monitoramento de arboviroses, foram 6.547.438 de casos prováveis de dengue, 5.613 mortes confirmadas e 1.499 óbitos em investigação em 2024. A Organização Mundial da Saúde (OMS) define a Qdenga como uma vacina viva atenuada que contém versões enfraquecidas dos quatro sorotipos do vírus causador da dengue. A organização recomenda que a dose seja aplicada em crianças e adolescentes de 6 a 16 anos em locais com alta transmissão de dengue. A Qdenga deve ser administrada em esquema de duas doses com intervalo de três meses entre elas – esquema vacinal atualmente adotado no Brasil. O imunizante teve seu registro aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa) em março de 2023. O processo permite a comercialização da vacina no Brasil, desde que mantidas as condições aprovadas. Em dezembro do ano passado, o ministério anunciou a incorporação do insumo no Sistema Único de Saúde (SUS). A vacina começou a ser aplicada na rede pública de saúde em fevereiro. Em razão da quantidade limitada de doses a serem fornecidas pelo próprio fabricante, a imunização foi feita apenas em crianças e adolescentes de 10 a 14 anos de idade, faixa etária que concentra o maior número de hospitalizações depois dos idosos. Pessoas com mais de 60 anos não têm indicação para receber a dose em razão da ausência de estudos clínicos. Além da Qdenga, também está em desenvolvimento uma vacina contra a dengue pelo Instituto Butantan. A previsão é que, ainda este ano, o pedido de registro seja submetido à Anvisa.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou, nesta segunda-feira (14), o início dos testes da vacina LepVax, a primeira para a hanseníase que será avaliada no país. As informações são do Tribuna da Bahia. O Instituto Oswaldo Cruz (IOC/Fiocruz) será responsável pelo ensaio. Já o Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos/Fiocruz) é o patrocinador. Segundo a Fiocruz, o estudo terá participação de 54 voluntários sadios. Além de avaliar a segurança e a imunogenicidade da vacina, a pesquisa vai investigar a segurança em duas formulações da vacina, com baixa e alta dose de antígeno. Para isso, os participantes serão divididos aleatoriamente em três grupos. Dois receberão a vacina, sendo um com dose baixa e outro com dose alta. O terceiro grupo receberá o placebo. Independentemente da dosagem, baixa ou alta, a vacinação será realizada em três aplicações, com intervalo de 28 dias entre elas. Depois disso, os participantes serão acompanhados por um ano, totalizando 421 dias de ensaio clínico.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) publicou nesta terça-feira (24) uma resolução que proíbe a venda de duas marcas de azeite: a Serrano e Cordilheira. Segundo o órgão, os produtos das marcas importadas estavam sendo distribuídos irregularmente por empresas desconhecidas no Brasil, sem garantias de segurança e qualidade. A proibição inclui não só a venda, mas também a fabricação, propaganda e uso desses produtos. Na mesma resolução, a Anvisa também suspendeu a comercialização e recolheu o lote 030424158 de coco ralado da marca Coco & Cia. As informações são do G1. O texto publicado no Oficial da União explica que o motivo foi um resultado insatisfatório em testes que detectaram a presença de dióxido de enxofre acima do permitido no lote. A Anvisa determinou a retirada do produto do mercado e proibiu sua distribuição, propaganda e uso. As três empresas envolvidas não se pronunciaram sobre o caso, até o momento.
 Foto: G1/Freepik
Foto: G1/Freepik A Agência Nacional de Vigilância Sanitária (Anvisa) emitiu um alerta nesta segunda-feira (16) sobre os riscos do uso de medicamentos agonistas GLP-1 em pacientes que passarão por anestesia ou sedação profunda. Entre os remédios mencionados estão a semaglutida, liraglutida, lixisenatida, tirzepatida e dulaglutida. As informações são do G1. Esses medicamentos, usados principalmente no tratamento de diabetes e obesidade, podem retardar o esvaziamento do estômago, o que aumenta o risco de aspiração durante procedimentos médicos. Isso significa que o conteúdo do estômago pode entrar nos pulmões, o que pode resultar numa pneumonia. Por esse motivo, a agência alerta que os profissionais de saúde devem verificar se os pacientes que passarão por cirurgias fazem uso desses medicamentos. A Anvisa alerta ainda que, nesses casos, os profissionais devem tomar as devidas precauções para garantir a ausência de conteúdo gástrico residual antes da anestesia. Da mesma forma, os pacientes devem informar seus médicos sobre o uso desses medicamentos, caso tenham uma cirurgia marcada. Se houver reações adversas, elas devem ser notificadas no sistema VigiMed da Anvisa. A plataforma permite que cidadãos, profissionais de saúde, detentores de registro de medicamentos e patrocinadores de estudos possam reportar suspeitas de eventos adversos relacionados a medicamentos e vacinas.
 Foto: Marcello Casal Jr/Agência Brasil
Foto: Marcello Casal Jr/Agência Brasil A diretoria colegiada da Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta quarta-feira (10) o projeto-piloto para implementação da bula digital de medicamentos no Brasil. A proposta é que seja incluído nas embalagens de medicamentos específicos um código de barras bidimensional (QR Code) para leitura rápida. Segundo a Agência Brasil, o projeto terá vigência até 31 de dezembro de 2026. As informações coletadas e monitoradas durante o período, segundo a Anvisa, devem servir como subsídio para futura regulamentação definitiva da bula digital. Em seu voto, o relator diretor Daniel Pereira avaliou que a proposta de implementação da bula digital no Brasil caminha na direção da modernização e da transformação digital no setor da saúde e está alinhada com a tendência mundial. “Constitui o primeiro passo para que se inicie a transição da informação sobre medicamentos em papel para a eletrônica, e gerando uma oportunidade para aprimorar a acessibilidade e personalização das informações de saúde”, disse.
 Foto: istock
Foto: istock A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a importação, fabricação, manipulação, comercialização, propaganda e o uso de produtos à base de fenol em procedimentos de saúde em geral ou estéticos. A resolução foi publicada no Diário Oficial da União. No início deste mês, um jovem de 27 anos morreu em São Paulo após complicações geradas por um peeling de fenol. O rapaz fez o procedimento em uma clínica estética. A dona do local não tinha especialidade ou autorização para fazer esse tipo de peeling. A polícia investiga o caso como homicídio. A clínica foi interditada e multada. Em nota, a Anvisa informou que a proibição tem como objetivo zelar pela saúde e pela integridade física da população, “uma vez que, até a presente data, não foram apresentados à agência estudos que comprovem a eficácia e segurança do produto fenol para uso em tais procedimentos”. “A determinação ficará vigente enquanto são conduzidas as investigações sobre os potenciais danos associados ao uso desta substância química, que vem sendo utilizada em diversos procedimentos invasivos”, completou a Anvisa.
 Foto: Divulgação
Foto: Divulgação A Agência Nacional de Vigilância Sanitária (Anvisa) publicou nesta quarta-feira (24) resolução que proíbe a fabricação, a importação, a comercialização, a distribuição, o armazenamento, o transporte e a propaganda de dispositivos eletrônicos para fumar, popularmente conhecidos como cigarro eletrônico. O texto define os dispositivos eletrônicos para fumar como “produto fumígeno cuja geração de emissões é feita com auxílio de um sistema alimentado por eletricidade, bateria ou outra fonte não combustível, que mimetiza o ato de fumar”. Estão incluídos na categoria e, portanto, proibidos: produtos descartáveis ou reutilizáveis; produtos que utilizem matriz sólida, líquida ou outras, dependendo de sua construção e design; produtos compostos por unidade que aquece uma ou mais matrizes: líquida (com ou sem nicotina); sólida (usualmente composta por extrato ou folhas de tabaco – trituradas, migadas, moídas, cortadas ou inteiras, ou outras plantas); composta por substâncias sintéticas que reproduzam componentes do tabaco, de extratos de outras plantas; por óleos essenciais; por complexos vitamínicos, ou outras substâncias; produtos conhecidos como e-cigs, electronic nicotine delivery systems (ENDS), electronic non-nicotine delivery systems (ENNDS), e-pod, pen-drive, pod, vapes, produto de tabaco aquecido, heated tobacco product (HTP), heat not burn e vaporizadores, entre outros. A publicação proíbe ainda o ingresso no país de produto trazido por viajantes por qualquer forma de importação, incluindo a modalidade de bagagem acompanhada ou bagagem de mão. “O não cumprimento desta resolução constitui infração sanitária”, destacou a Anvisa no texto.
 Foto: Ministério da Saúde
Foto: Ministério da Saúde Em reunião nesta sexta-feira (19), a diretoria da Agência Nacional de Vigilância Sanitária (Anvisa) formou maioria para manter proibidos os cigarros eletrônicos no Brasil. A norma aprovada substitui a resolução estipulada em 2009, endurecendo as regras atuais. A resolução aprovada pelo colegiado é mais dura que a norma vigente, pois, além de proibir a venda, propaganda e importação dos aparelhos, coíbe produção, armazenamento, distribuição e transporte dos Dispositivos Eletrônicos para Fumar (DEFs), vapes, pods, entre outros, no país. A nova regra estabelece normas mais bem definidas sobre os aparelhos e estipula que os DEF’s são todo “produto fumígeno cuja geração de emissões é feita com auxílio de um sistema alimentado por eletricidade, bateria ou outra fonte não combustível, que mimetiza o ato de fumar”.
 Foto: Divulgação/Conselho Federal de Farmácia
Foto: Divulgação/Conselho Federal de Farmácia A Agência Nacional de Vigilância Sanitária (Anvisa) determinou que o álcool líquido 70% não seja mais vendido e comercializado em supermercados e outros estabelecimentos no Brasil. A medida entra em vigor, a partir do próximo dia 30 de abril. A determinação da Anvisa não afetará a venda do álcool 70% em gel, será somente proibido a venda do produto líquido. A comercialização do produto já era proibida há mais de 20 anos, por conta da sua alta inflamabilidade. No entanto, a venda do produto foi flexibilizada pela agência por conta da pandemia da Covid-19. A Anvisa reforçou ainda por meio de nota à imprensa, que além do álcool líquido 70%, os consumidores ainda vão continuar tendo outras opções para limpeza disponíveis no mercado, como produtos desinfetantes que não contêm álcool, mas ainda são eficazes contra germes, incluindo o vírus da Covid-19.
 Foto: Lay Amorim/Achei Sudoeste
Foto: Lay Amorim/Achei Sudoeste A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou uma vacina destinada à prevenção em bebês contra o vírus sincicial respiratório (VSR), causador de infecções no trato respiratório, principalmente da bronquiolite infantil. Para gerar a proteção nos bebês, o imunizante é aplicado nas grávidas. De acordo com o G1, quando acometida por uma bronquiolite, a criança tem uma maior produção de muco nos pulmões e, por isso, encontra mais dificuldade para a chegada do oxigênio ao sangue. O VSR é responsável por 75% de todos os casos de bronquiolite, principalmente entre os menores de 2 anos. Nessa faixa etária, a mortalidade em decorrência da infecção é maior. O imunizante Abrysvo, fabricado pela farmacêutica Pfizer, está indicado para a prevenção de doenças do trato respiratório em crianças desde o nascimento até os seis meses, por imunização ativa em gestante. Ou seja, a vacina deve ser aplicada nas grávidas durante o segundo ou terceiro trimestre da gestação. A agência já tinha autorizado o registro da vacina Arexvy (GlaxoSmith Kline), também destinada à prevenção de doenças causadas pelo VSR, porém com indicação restrita à população com idade superior a 60 anos.
 Foto: Divulgação
Foto: Divulgação Desde 2009, pesquisadores do Instituto Butantan estudam a produção de nova vacina contra a dengue. O imunizante se encontra atualmente em fase final de ensaios clínicos – em junho, o último paciente voluntário a receber a dose experimental completa cinco anos de acompanhamento. A previsão do instituto é que, entre junho e julho, o pedido de registro seja submetido para análise da Agência Nacional de Vigilância Sanitária (Anvisa). Maior produtor de vacinas e soros da América Latina e principal produtor de imunobiológicos do Brasil, o Butantan é responsável pela maioria dos soros utilizados no país contra venenos de animais peçonhentos, toxinas bacterianas e o vírus da raiva. Também responde por grande volume da produção nacional de vacinas – produz, por exemplo, 100% das doses contra o vírus influenza usadas na Campanha Nacional de Vacinação contra a Gripe. Classificada pelo próprio Butantan como problema de saúde pública no Brasil, a dengue contabiliza um total de quatro sorotipos. O tipo 3, que não circulava de forma epidêmica no país há mais de 15 anos, voltou a registrar casos. Quem pega dengue uma vez, portanto, pode ser reinfectado por outro sorotipo. Quando isso acontece, o quadro pode evoluir para o que é popularmente chamado de dengue grave, com risco aumentado de morte do paciente. A vacina em desenvolvimento pelo Butantan, assim como a Qdenga, do laboratório japonês Takeda, é tetravalente e contém os quatro tipos do vírus atenuados. “Por estarem enfraquecidos, os vírus atenuados induzem a produção de anticorpos sem causar a doença e com poucas reações adversas”, destacou o instituto. O imunizante brasileiro, entretanto, conta com um diferencial: será administrado em dose única, contra as duas doses necessárias da Qdenga.
 Foto: Reprodução/Redes Sociais
Foto: Reprodução/Redes Sociais Personalidades da música, do esporte e da televisão se uniram à campanha que tenta salvar o menino Enrico, de 5 anos, de Varginha (MG), que sofre de Distrofia Muscular de Duchenne e precisa de um remédio avaliado em R$ 15 milhões. O medicamento só existe nos Estados Unidos e não é aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa), no Brasil. Nesta semana, a Justiça negou à família da criança um pedido para que União arque com o custo do medicamento e todas as despesas médicas do menino. Depois disso, o pai da criança fez um desabafo nas redes sociais. Para conseguir o dinheiro, a família de Varginha (MG) recorreu às redes sociais para pedir ajuda e já foi vítima até de golpe de estelionatários que tentaram se aproveitar da campanha. Enquanto a família tenta conseguir o dinheiro para o medicamento, a luta é uma corrida contra o tempo. O menino Enrico tem hoje 5 anos e 4 meses e só poderia tomar a medicação antes de completar 6 anos. Zico, Tony Ramos, Rogério Flausino, Maria Cecília e Rodolfo, Raul Plasman, Ronaldinho Gaúcho, Ana Castela, José Neto e Cristiano, Tatá Werneck, Isis Valverde... a lista é grande. Todas essas personalidades já gravaram vídeos para as redes sociais convocando o público a ajudar. “A gente está aqui junto unindo forças, muita gente já entrou nessa campanha maravilhosa pra gente ajudar a salvar o nosso querido Enrico e que somente com a colaboração de todos nós vai vencer essa batalha”, diz no vídeo o também Sul-mineiro Rogério Flausino, líder da banda Jota Quest.
 Foto: Marcelo Camargo/Agência Brasil
Foto: Marcelo Camargo/Agência Brasil A droga contra Covid-19 fabricada pelo laboratório Pfizer, Paxlovid, recebeu registro definitivo da Agência Nacional de Vigilância Sanitária (Anvisa) no último dia 29 de dezembro. Até então seu uso havia sido aprovado apenas em caráter emergencial, o que ocorreu em março de 2022, durante a fase mais crítica da pandemia do vírus. No mesmo ano, o medicamento já havia sido incorporado ao Sistema Único de Saúde (SUS) por meio da Comissão Nacional de Incorporação de Tecnologias ao SUS (Conitec), ligada ao Ministério da Saúde. A venda do produto em farmácias também foi autorizada naquele ano. Segundo a Anvisa, o registro emergencial é concedido para medicamentos e vacinas com uso restrito na população, em geral para grupos de risco bem definidos. Há também a possibilidade de incorporar novas recomendações ao uso emergencial a partir de estudos científicos ainda em andamento. Já com o registro definitivo, o medicamento pode ser utilizado por toda a população sem critérios em bula alterados.
 Foto: Rafa Neddermeyer/Agência Brasil
Foto: Rafa Neddermeyer/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) cancelou, nesta quarta-feira (20), mais de 500 registros de produtos para alisar ou ondular os cabelos. A medida é baseada em um artigo que determina o cancelamento do registro para empresas que não fizeram as adequações de rotulagem previstas na resolução. O cancelamento estava previsto no art. 14-A da RDC 409, de 27 de julho de 2020. A iniciativa estabelece o cancelamento do registro para empresas que não fizessem adequações de rotulagem previstas na resolução. Com a norma, a fabricação ou comercialização dos produtos que constam na lista configura infração sanitária, sujeitando o infrator às penalidades previstas na Lei 6.437/1977.
 Foto: Divulgação
Foto: Divulgação O Instituto Butantan submeteu à Agência Nacional de Vigilância Sanitária (Anvisa) o pedido de registro da primeira vacina do mundo contra a chikungunya. O pedido foi realizado nesta terça-feira (12). Os resultados dos ensaios clínicos afirmaram que a vacina de dose única tem capacidade de estimular a produção de anticorpos em 98,9% dos voluntários. O imunizante é feito por meio de um vírus enfraquecido da chikungunya e vinha sendo desenvolvido desde 2020. No Brasil, até setembro de 2023, foram notificados cerca de 143 mil casos de chikungunya. O número de mortes até o mês de recorte foi de 82 pessoas. O Butantan afirma que o estudo foi feito com 750 voluntários adolescentes de 12 a 17 anos que residem em áreas endêmicas da doença. Entre os jovens vacinados, 98,9% apresentaram anticorpos após a aplicação do imunizante.
 Foto: José Cruz/Agência Brasil
Foto: José Cruz/Agência Brasil A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, nesta segunda-feira (4), o registro de uma vacina indicada para a prevenção da doença do trato respiratório inferior causada pelo vírus sincicial respiratório (VSR). Trata-se do principal vírus causador de bronquiolite. De acordo com a Agência Brasil, o imunizante aprovado é registrado como Arexvy, produzido pela empresa GlaxoSmith Kline. A vacina foi aprovada pela Anvisa para uso em adultos com 60 anos de idade ou mais. Ela é aplicada de forma intramuscular, em dose única. Ainda de acordo com a agência, a tecnologia utilizada para a vacina é de proteína recombinante, quando uma substância semelhante à presente na superfície do vírus é fabricada na indústria e utilizada para estimular a geração de anticorpos, responsáveis pela imunidade. “O pedido de registro do medicamento foi enquadrado como prioritário, nos termos da Resolução da Diretoria Colegiada (RDC) 204/2017, por se tratar de condição séria debilitante. Além disso, é uma doença de grande impacto público, principalmente pela faixa etária atingida, que possui grande índice de hospitalizações causadas por infecção pelo VSR”, destacou a Anvisa, em nota.
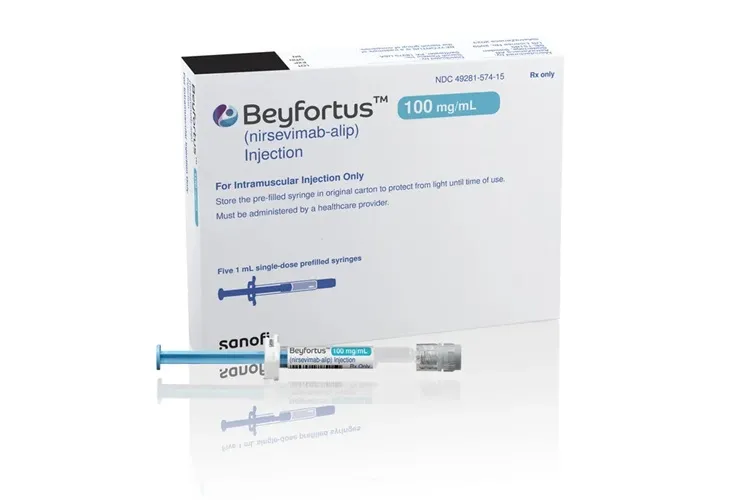 Foto: AstraZeneca
Foto: AstraZeneca A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta segunda-feira (30) o registro do Beyfortus (nirsevimabe), um medicamento indicado para a prevenção do vírus sincicial respiratório (VSR). O nirsevimabe é um anticorpo monoclonal, ou seja, uma proteína produzida em laboratório que imita a capacidade do nosso sistema imunológico de combater patógenos nocivos, como os vírus. Ainda não há uma data para o início da comercialização do medicamento no Brasil. Atualmente, o Sistema Único de Saúde (SUS) já oferece um medicamento para prevenir o VSR: o palivizumabe, também um anticorpo monoclonal. Na rede pública, ele é indicado para bebês com menos de 1 ano de idade que nasceram prematuros e crianças com menos de 2 anos com doenças pulmonares crônica ou cardíaca congênita. De acordo com uma revisão recente da Sociedade de Pediatria de São Paulo, porém, o nirsevimab é considerado mais eficaz na imunoprofilaxia (processos de prevenção) contra VSR em crianças prematuras com menos de 1 ano. A autorização para uso do novo medicamento no Brasil foi dada à farmacêutica francesa Sanofi Medley. O registro do remédio foi publicado no Diário Oficial da União (DOU) no dia 26 de outubro. Segundo a Anvisa, o medicamento será oferecido como uma solução injetável, para administração intramuscular em recém-nascidos e bebês lactentes que estão entrando ou já estão em sua primeira temporada do VSR (maio a setembro, segundo o Ministério da Saúde). O medicamento inibe a etapa essencial de fusão da membrana no processo de invasão viral, neutralizando o vírus e bloqueando a fusão célula a célula. Ainda de acordo com a Anvisa, ele deve ser aplicado em dose única e visa fornecer proteção durante toda a temporada do VSR.
 Foto: Lay Amorim/Achei Sudoeste
Foto: Lay Amorim/Achei Sudoeste A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou na sexta-feira, 1º, o início de uma nova etapa do ensaio clínico com a SpiN-Tec - a primeira vacina 100% nacional contra a covid-19, desenvolvida pelo Centro de Tecnologia de Vacinas (CTVacinas) da Universidade Federal de Minas Gerais (UFMG). O objetivo é que o imunizante esteja disponível até o fim de 2024. Em nota, a Anvisa informou que o início da primeira fase do ensaio clínico foi autorizado pela agência em outubro do ano passado e, com base nos resultados preliminares de segurança e imunogenicidade obtidos, foi autorizado o prosseguimento do teste. “O objetivo dessa nova fase é obter dados adicionais de segurança e imunogenicidade, utilizando a dose que apresentou o melhor desempenho na primeira fase”, informa a nota. Nessa nova fase serão incluídas 372 pessoas saudáveis de ambos os sexos, com idade entre 18 e 85 anos, que já tenham completado o esquema vacinal primário contra a covid-19 e pelo menos uma dose de reforço há pelo menos seis meses. Pessoas que tiveram covid-19 há pelo menos seis meses também podem participar do estudo. O ensaio clínico, de acordo com a Anvisa, está sendo realizado em três centros em Belo Horizonte: na Faculdade de Medicina da UFMG, no Centro Freire de Pesquisa Clínica e no Centro Infection Control. A segunda etapa vai começar tão logo os voluntários sejam reunidos pelos centros de pesquisa. Os resultados da primeira fase de testes da SpiN-Tec foram divulgados pela Fiocruz em maio deste ano. Os dados preliminares não indicaram problemas de segurança e apontaram resposta imunológica ao vírus. A vacina SpiN-Tec consiste na fusão de duas proteínas (S e N), que resultam em uma proteína quimera. Essa associação confere à nova vacina um diferencial em relação aos demais imunizantes, que contemplam apenas a proteína S. Desta forma, os desenvolvedores do novo imunizante esperam oferecer uma proteção mais ampla contra possíveis novas variantes.
 Foto: Freepik
Foto: Freepik A ejaculação precoce é uma das disfunções sexuais mais prevalentes: ela acomete 1 a cada 3 brasileiros acima de 18 anos, segundo dados da Sociedade Brasileira de Urologia (SBU). As informações são do jornal o Globo. Recentemente, a Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o primeiro medicamento específico para o problema com indicação em bula e uso sob demanda. Essa medicação já é usada em mais de 50 países, como Itália, Reino Unido, Austrália, Argentina e Uruguai. Pessoas com ejaculação precoce normalmente chegam ao orgasmo em menos de um minuto. O tempo ejaculatório considerado normal, do momento da penetração até a ejaculação, é de três a seis minutos. A disfunção está, em muitos casos, relacionada à ansiedade. Há dois tipos de ejaculação precoce, a primária, quando o paciente sofre com isso desde o primeiro relacionamento, e a secundária, quando ele passa a apresentar uma ejaculação mais rápida como efeito colateral a algum fator ocorrido, de fundo psicológico ou físico. A dificuldade de manter uma relação sexual por mais tempo acaba trazendo prejuízos emocionais para o paciente, assim como problemas para o relacionamento. Com o princípio ativo de cloridrato de dapoxetina (com o nome comercial de Prosoy, comercializado pela Farmoquímica), o remédio deve ser tomado de uma a três horas antes da relação sexual, por isso é considerado sob demanda. Antes da chegada do novo medicamento, as únicas alternativas de tratamento para a ejaculação precoce eram com o uso ansiolíticos e antidepressivos, por conta do fundo emocional do problema. Os fármacos eram de uso contínuo e demoravam quase 1 mês para começar a surtir algum efeito. O remédio deve ser prescrito por um médico e sua venda é controlada (tarja vermelha). Ele é vendido em comprimidos em dois tipos de dosagens: de 30 e 60mg. No entanto, a bula recomenda que o paciente comece com a dose de 30mg tome, no máximo, um comprimido a cada 24 horas.
